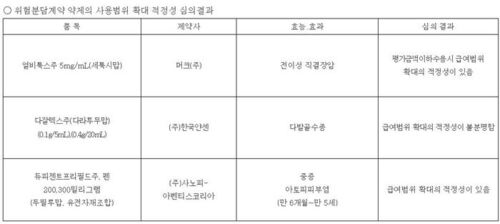
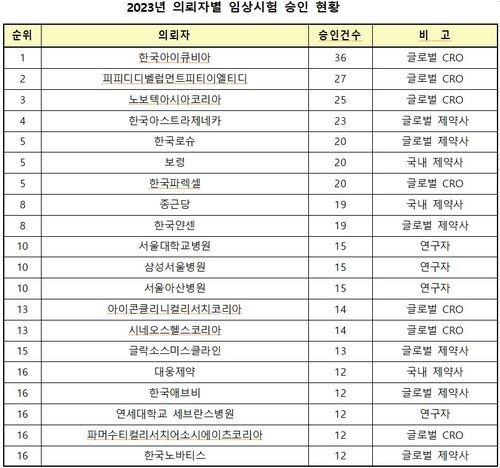
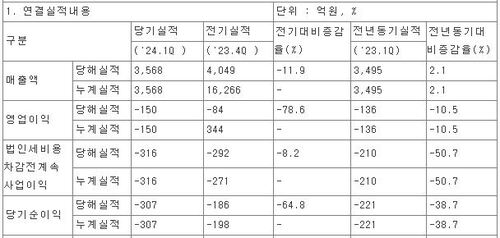
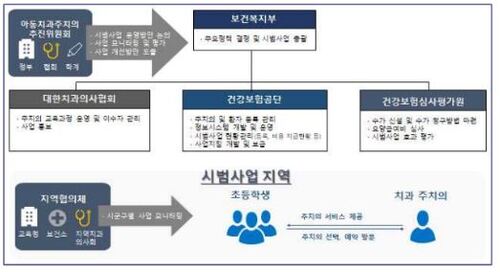
'또 다른 국산 루센티스 바이오시밀러' 허가 카운트다운 시작
종근당 안과질환 치료제 'CKD-701' 허가 신청 1년…삼성바이오에피스 '아멜리부' 이어 판매허가 앞둬, "빠르면 이달 내 성과"
'또 다른 국산 루센티스 바이오시밀러' 허가 카운트다운 시작종근당 안과질환 치료제 'CKD-701' 허가 신청 1년…삼성바이오에피스 '아멜리부' 이어 판매허가 앞둬, "빠르면 이달 내 성과"안과질환 치료제로 또 다른 국내 개발 루센티스 바이오시밀러의 허가에 대한 카운트다운이 시작됐다.
올해 국산 루센티스 바이오시밀러로 '아멜리부주'(삼성바이오에피스·국내 유통 및 판매는 삼일제약)가 허가를 받은 데 이어 'CKD-701'(종근당)도 허가를 앞두고 있다.
CKD-701은 허가 신청된지 1년 가까이 되며 조만간 허가가 예상되고 있다.
업계와 증권가 등에선 1~2개월 내 CKD-701의 품목 허가가 관측되고 있다.
제약사 한 개발 담당자는 "바이오의약품(바이오시밀러 포함) 허가까지 통상 1년 이상 걸린다"며 "CKD-701가 큰 문제 없으면 빠르면 이달 내 또는 3분기(7~9월) 안에 성과(허가 성과)가 나타날 전망"이라고 말했다.
회사 측도 최근 CKD-701의 판매허가 획득을 위한 카운트다운에 들어갔다.
루센티스 바이오시밀러 개발과 관련해 국내사 중 삼성바이오에피스에 이어 임상(3상)을 마친 종근당이 1년 전 오리지널약(루센티스주) 대비 효과 입증을 공식적으로 발표한 바 있다.
회사에 따르면 CKD-701은 국내 25개 의료기관에서 신생 혈관성(습성) 연령 관련 황반변성 환자 312명을 대상으로 루센티스와 비교 3상이 진행됐고 그 결과, 3개월 시점의 최대 교정시력(BCVA)에서 15글자 미만의 시력 손실을 보인 환자의 비율은 큰 차이가 없었다.
이와 연관된 3상에선 CKD-701 투약군이 97.9%(143/146명), 루센티스군이 98.6%(143/145명)로 나타났다.
이를 토대로 이 회사는 작년 7월28일 식품의약품안전처에 품목 허가를 신청했다.
이 회사는 CKD-701이 허가를 받으면 빈혈치료제 네스프 바이오시밀러 ‘네스벨’에 이어 두 번째 바이오시밀러를 갖게 된다.
라니비주맙 성분의 CKD-701는 혈관내피생성인자(Vascular endothelial growth factor·VEGF)-A에 결합, 신생혈관 형성 억제를 기전으로 하는 황반변성, 당뇨병성 황반부종 등의 안과질환 치료제로 평가받고 있다.
제넨텍이 개발하고 로슈와 노바티스가 판매하는 루센티스는 미국과 유럽에선 특허가 만료됐다. 루센티스의 작년 세계 매출은 약 4조4,000억원을, 국내에선 약 340억원을 각각 기록했다. <저작권자 ⓒ 뉴스맥 무단전재 및 재배포 금지>
댓글
안전성 콕! 관련기사목록
|
많이 본 기사
|