신약 '펠루비정' 허가 사항 변경에 '펠루비에스·제네릭 2품목'도
식약처, 대원제약 '펠루비프로펜' 재심사 결과 토대 적응증별 약물유해반응 등 알려…휴온스 '펠로엔'·영진약품 '펠프스' 포함
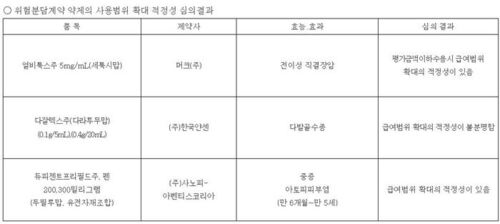
신약 '펠루비정' 허가 사항 변경에 '펠루비에스·제네릭 2품목'도식약처, 대원제약 '펠루비프로펜' 재심사 결과 토대 적응증별 약물유해반응 등 알려…휴온스 '펠로엔'·영진약품 '펠프스' 포함신약 '펠루비정'(대원제약)의 허가 사항 변경에 '펠루비에스정'과 제네릭 2개 품목이 포함됐다.
식품의약품안전처에 따르면 펠루비프로펜 성분의 펠루비의 재심사 결과를 토대로 이 성분을 변경한 펠루비에스와 (이 성분의) 제네릭 '펠로엔'(휴온스)과 '펠프스'(영진약품)에 대해 사용상 주의 사항을 비롯한 허가 사항이 바뀐다.
적응증별로 먼저 골관절염 및 허리 통증 환자를 대상으로 한 재심사에 따른 국내 시판 후 조사를 통해 3,381명을 대상으로 한 사용성적조사 결과, 인과관계에 상관없이 유해사례 발현율은 2.28%(77명·90건)로 보고됐다.
이 중 이 약과 인과관계가 있는 약물유해반응은 1.54%(52명·62건)으로 조사됐다.
또 국내 시판 후 이상사례(재심사 이상사례 포함) 보고 자료(1989~2021.12.31)를 토대로 실마리 정보 분석·평가 결과 추가적으로 확인된 이상사례는 근골격계-골격통, 각종 면역계 장애-아나필락시스 반응(아나필락시스성 쇼크 포함), 피부 및 피하조직계-혈관 부종(국내 중대한 이상사례 분석 평가 결과)으로 조사됐다.
이 허가 사항은 올해 10월 말쯤 변경될 예정이다.
펠루비는 지난 2007년 선보인 국내 개발 12호 신약이며, 펠루비에스는 올 5월 허가된 후 이달부터 급여되고 있다.
펠루비에스는 펠루비 주성분 펠루비프로펜에 트로메타민 염을 부착한 제제로 펠루비와 같이 골관절염, 류마티스관절염, 요통, 급성 상기도염의 해열에 대한 적응증을 갖고 있다. 펠로엔과 펠프스는 작년 펠루비프로펜의 특허를 극복, 지금까지 펠루비 제네릭으로 허가된 제품이다. <저작권자 ⓒ 뉴스맥 무단전재 및 재배포 금지>
댓글
안전성 콕! 관련기사목록
|
많이 본 기사
|