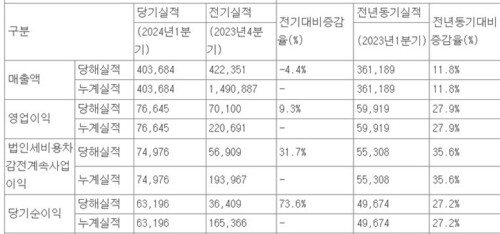
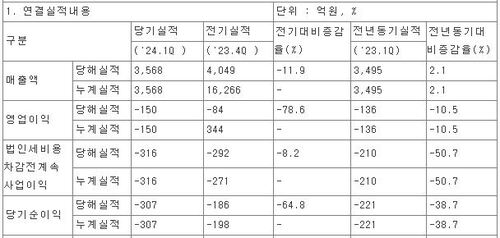
바이젠셀, '급성백혈병 신약' 1상 최종 단계 진입…서울성모 등 7곳 임상
보령 관계사로 바이티어 플랫폼 'VT-Tri(1)-A' 코호트2 마쳐
이상반응·용량제한독성 발견 안돼 "코호트3 환자 등록 시작"
바이젠셀, '급성백혈병 신약' 1상 최종 단계 진입…서울성모 등 7곳 임상보령 관계사로 바이티어 플랫폼 'VT-Tri(1)-A' 코호트2 마쳐
|
 자료 : 바이젠셀 |
이후 이 회사는 1상에선 암세포의 종양 면역 회피 기능을 극복하기 위해 암세포가 가진 3가지 공통 종양항원(WT1, Survivin, TERT)을 동시에 타깃하도록 개량한 파이프라인 'VT-Tri(1)-A'로 연구 및 개발을 진행 중이라고 덧붙였다.
이 회사 개발본부장 손현정 상무는 "코호트2에서 중대한 이상반응이나 특이 사항 없이 코호트3 환자 등록을 시작할 수 있게 됐다"며 "1상을 비롯한 앞으로의 과정들도 순차적으로 잘 마무리해 급성골수성백혈병 환자들에게 새로운 치료 대안이 될 수 있도록 노력할 것"이라고 말했다.